Policistosi ovarica
Sindrome dell’ovaio policistico
La sindrome dell’ovaio policistico (PCOS), chiamata anche PCO e micropolicistosi ovarica, descritta per la prima volta da Stein e Leventhal nel 1935, è una condizione patologica endocrina, complessa ed eterogenea, caratterizzata essenzialmente da : 1. Iperandrogenismo clinico e/o biochimico. 2.Oligo-anovulazione. 3.Ovaie con aspetto ultrasonografico microcistico (Rotterdam – ESHRE/ASRM sponsored PCOS Consensus Workshop Group, 2004).
Si può associare ad una serie di alterazioni biochimiche quali elevate concentrazioni plasmatiche di Lh e/o insulina e/o insulino-resistenza, nonchè a infiammazione cronica delle ovaie. L’evidenza biochimica del coinvolgimento di vari organi con conseguente iperandrogenismo di origine ovarica e corticosurrenalica, insulinoresistenza e anomala funzione delle cellule ß pancreatiche, sollevano importanti questioni: la PCOS è rappresentata da più affezioni o i fattori che influenzano la funzione riproduttiva determinano un fenotipo PCOS multisistemico? Le risposte a queste domande acquisiscono un profondo significato quando si contempla il ruolo genetico nella PCOS e la probabile interazione con fattori ambientali.
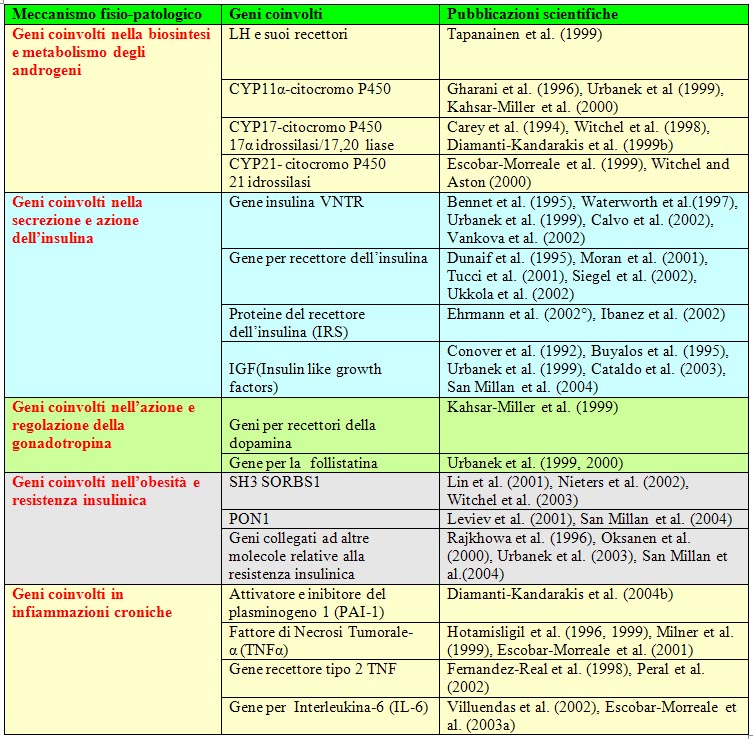
L’iperincrezione di Lh è stata oggetto di un recente studio multicentrico che ha indagato sul polimorfismo del gene b Lh senza però trovare chiare conferme alla correlazione con la PCOS (Tapanaim e al,1999). L’iperandrogenismo sarebbe associato al comportamento del gene responsabile del distacco della catena laterale del colesterolo (CYP 11A) quale possibile responsabile dell’anomala steroidogenesi (Gharani e al, 1996). Secondo altri studi potrebbe essere anche attribuita all’aumento dell’attività enzimatica svolta dal citocromo CYP17. L’iperfosforilazione della serina nella molecola dell’enzima stimola significativamente l’attività steroidogenetica sia a livello ovarico sia a livello surrenalico, causando un aumento della produzione di androgeni. L’insulino-resistenza, difetto metabolico frequentemente riscontrato nelle PCOS, è riferibile ad una ridotta funzionalità del recettore insulinico sostenuta da una iperfosforilazione dei residui serinici del recettore. La sua eccessiva fosforilazione, determinando anomalie nella attivazione post-recettoriale, riduce la sensibilità all’ormone, alla sua attività endocrina e stabilisce così una situazione di insulino-resistenza (Dunaif e al,1995; Morain e al,2001). Pertanto un singolo difetto molecolare è in grado di determinare due dei principali disturbi della sindrome. L’iperinsulinismo, conseguenza dell’ eccesso di produzione delle cellule ß-pancreatiche, risulta essere uno dei fattori di rischio per la futura comparsa di un diabete non insulino-dipendente. Uno studio ha evidenziato che la regione VNTR5’ del gene per la secrezione dell’insulina rappresenta il locus responsabile per tale alterazione (Waterworth e coll., 1997) anche se altre ricerche non hanno confermato tale correlazione (Urbanek e al,1999).
Terapie
Per lungo tempo le terapie per la PCOS sono state focalizzate sulla soppressione dell’attività androgenica e sull’induzione dell’ovulazione. Più recentemente è stato dimostrato che la effettiva riduzione della insulino-resistenza, ottenuta con metformina o troglitazone, ripristina cicli mestruali regolari e quindi fertilità. Tali molecole riducono i livelli glicemici in soggetti affetti da diabete mellito, mentre negli individui normali inducono una diminuzione solo di insulina e non di glucosio (Lord e al,2004). Metformina: introdotta nel 1957 come ipoglicemizzante orale nel diabete mellito non insulino dipendente, migliora l’utilizzazione periferica del glucosio. Riduce gli elevati livelli di ormoni androgeni grazie anche ad un aumento della SHBG, la proteina legante gli ormoni sessuali (Velazquez e al.,1994) con benefici effetti sul profilo lipidico sierico nelle obese (Giugliano e al,1993). Non vi sono chiare evidenze di risultati migliori con l’utilizzo di metformina in donne sottoposte a fertilizzazione in vitro, comunque ulteriori studi sono necessari. La sicurezza in gravidanza è stata sufficientemente stabilita. La somministrazione di metformina dovrebbe essere proseguita per tutta la gravidanza onde prevenire il rischio di aborto e lo sviluppo di diabete gestazionale (M.A. Checa e al,2005). In monoterapia sono necessarie posologie crescenti sino a 1500 a 2000 mg/die con possibili effetti collaterali di origine gastrointestinale (Nestler,2001).
Contraccettivi orali (CO): inibiscono la secrezione ipofisaria di gonadotropine; aumentano i livelli di SHBG e riducono quindi la quantità degli androgeni liberi circolanti. Non agiscono sulle alterazioni endocrino-metaboliche, non correggono il basso grado di infiammazione, né agiscono sull’obesità (Baumann e Rosenfield, 2002). Alcuni CO sono costituiti da una combinazione di estrogeno con ciproterone acetato che ha una spiccata azione antiandrogena.
Flutamide: la flutamide è un inibitore non steroideo di recettori androgenici. Uno studio recente ha evidenziato che, in associazione con la metformina, a basse posologie ripristina la fisiologica ovulazione, soprattutto nei soggetti iperinsulinemici con iperandrogenismo, ma è controindicata in gravidanza per la potenziale embriotossicità (L. Ibanez e F.de Zegher,2006).
Tabella






Youtube